Vsebina
Termodinamika - je pomemben veja fizike, ki preučuje in opisuje termodinamične sisteme, ki so v ravnovesju ali k njemu težijo. Da bi z enačbami termodinamike opisali prehod iz nekega začetnega v končno stanje, je treba aproksimirati kvazistatični proces. Kaj je ta približek in kakšne vrste so ti procesi, bomo obravnavali v tem članku.
Kaj pomeni kvazistatični proces?
Kot vemo, termodinamika za opis stanja sistema uporablja niz makroskopskih značilnosti, ki jih je mogoče izmeriti eksperimentalno. Ti vključujejo tlak P, prostornino V in absolutna temperatura T. Če so v danem trenutku za obravnavani sistem znane vse tri veličine, se šteje, da je njegovo stanje določeno.
Pojem kvazistatičnega procesa pomeni, da obstaja prehod med dvema stanjema. Pri takšnem prehodu je povsem naravno, da se termodinamične lastnosti sistema spremenijo. Če so v vsakem časovnem trenutku, v katerem poteka prehod, za sistem znani T, P in V in če sistem ni daleč od svojega ravnovesnega stanja, potem pravimo, da poteka kvazistatični proces. Z drugimi besedami, zgoraj opisani proces je zaporedni prehod med nizom ravnovesnih stanj. Predpostavlja, da je zunanji vpliv na sistem neznaten, tako da ima sistem dovolj časa, da hitro doseže ravnovesje.
Dejanski procesi niso kvazistatični, zato bo zadevni koncept idealiziran. Na primer, ko se plin širi ali krči, v njem potekajo turbulentne spremembe in valovni procesi, ki zahtevajo določen čas za njihovo oslabitev. Kljub temu v nekaterih praktičnih primerih plinov, kjer se delci gibljejo z velikimi hitrostmi, ravnovesje nastopi hitro, zato se lahko različni prehodi med stanji v njih z veliko natančnostjo obravnavajo kot kvazistatični.

Enačba stanja in vrste procesov v plinih
Plin je priročno agregatno stanje snovi za preučevanje v termodinamiki. To je posledica dejstva, da je za njegov opis Obstaja preprosta enačba, ki povezuje vse tri zgoraj omenjene termodinamične količine. Ta enačba se imenuje zakon Clapeyrona-Mendelejeva. Ima naslednjo obliko:
P*V = n*R*T
S to enačbo se preučujejo vse vrste izoprocesov in adiabatnih prehodov ter izrisujejo grafi izobar, izoterm, izohor in adiabat. V enakosti je n količina snovi v sistemu, R pa je konstanta za vse pline. V nadaljevanju obravnavamo vse omenjene vrste kvazistatičnih procesov.
Izotermni prehod
Prvič so jo preučevali konec 17. stoletja na primeru različnih plinov. Ustrezne poskuse sta izvedla Robert Boyle in Edmund Marriott. Znanstveniki so prišli do naslednjega rezultata:
P*V = konst pri T = konst
Če povečamo tlak v sistemu, se njegova prostornina zmanjša sorazmerno s tem povečanjem, če je temperatura v sistemu konstantna. Tega zakona ni težko izpeljati iz same enačbe stanja.
Izoterma na grafu je hiperbola, ki se približuje točkama P in V.

Izobarični in izohorični prehodi
Izobarični (pri stalnem tlaku) in izohorični (pri stalnem volumnu) prehod v plinih so preučevali v začetku 19. stoletja. Velike zasluge pri njihovem preučevanju in odkrivanju ustreznih zakonov imata Francoza Jacques Charles in Gay-Lussac. Oba procesa sta matematično predstavljena na naslednji način:
V/T = konst s P = konst;
P/T = const z V = const
Oba izraza sledita iz enačbe stanja, pri čemer je ustrezni parameter konstanten.
Te prehode smo združili v enem odstavku dokumenta, saj imajo enak grafični prikaz. Za razliko od izoterme sta izobarični in izohorični proces ravni črti, ki kažeta neposredno odvisnost med prostornino in temperaturo oziroma tlakom in temperaturo.

Adiabatski proces
Od zgoraj opisanih izoprocesov se razlikuje po tem, da poteka v popolni toplotni izolaciji od okolje. Zaradi adiabatnega prehoda se plin širi ali krči, ne da bi izmenjeval toploto z zunanjim okoljem. Ustrezno se spremeni njegova notranja energija, tj:
dU = - P*dV
Za opis adiabatskega kvazistatičnega procesa je pomembno poznati dve količini: izobarično CP in izohorični CV toplotne kapacitete. Vrednost CP pove, koliko toplote je treba oddati sistemu, da se njegova temperatura pri izobaričnem širjenju poveča za 1 K. CV pomeni enako, le za ogrevanje pri konstantni prostornini.
Enačba tega postopka za idealno plina se imenuje Poissonova enačba. V parametrih P in V je zapisan na naslednji način:
P*Vγ = const
Pri tem se parameter γ imenuje adiabatni eksponent. Je enaka razmerju količin CP in CV. Za enatomni plin γ = 1,67, za dva atoma 1,4, če je plin sestavljen iz kompleksnejših molekul, γ = 1,33.

Ker adiabatni proces temelji izključno na lastnih notranjih energijskih virih, se adiabatni graf na osi P-V obnaša bolj naglo kot izotermni graf (hiperbola).
 Izobarični, izohorični, izotermni in adiabatni procesi za idealni plin
Izobarični, izohorični, izotermni in adiabatni procesi za idealni plin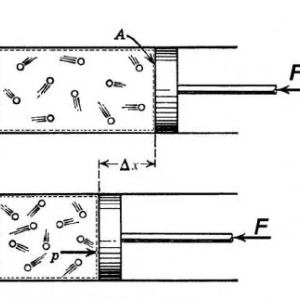 Adiabatni parametri: opredelitev in postopek
Adiabatni parametri: opredelitev in postopek Duševni procesi so... Značilnosti in vrste
Duševni procesi so... Značilnosti in vrste Metabolični procesi v telesu. Snovi, ki sodelujejo pri presnovi. Kako povečati presnovo
Metabolični procesi v telesu. Snovi, ki sodelujejo pri presnovi. Kako povečati presnovo Mendelejeva-clapeyronova enačba za reševanje problemov v termodinamiki
Mendelejeva-clapeyronova enačba za reševanje problemov v termodinamiki Samočiščenje tal - pomen, faze in procesi
Samočiščenje tal - pomen, faze in procesi Tehnološki procesi v strojništvu. Avtomatizirani sistemi za nadzor procesov
Tehnološki procesi v strojništvu. Avtomatizirani sistemi za nadzor procesov Enačba stanja idealnega plina in pomen absolutne temperature
Enačba stanja idealnega plina in pomen absolutne temperature Popoln enatomski plin. Enačba za notranjo energijo. Rešitev problema
Popoln enatomski plin. Enačba za notranjo energijo. Rešitev problema